Das Kategorisierungs-Schema finden Sie hier: http://bit.ly/Qavwqo
Die Untersuchungsmethode ist an dieser Stelle beschrieben: http://bit.ly/PIKS5h

Related Posts
Rauchen und MS
Was ist bekannt über den Einfluss des Rauchens auf den Verlauf der Multiplen Sklerose? Nützt oder schadet Rauchen?
Rauchen
Rauchen ist für viele gesundheitliche Probleme verantwortlich. Beispielsweise Veränderung der Lungen, der Haut, des Immunsystems, des Stoffwechsels, der Blutgefässe, …
Beispielsweise wurden Studien mit Zwillingen gemacht, der eine Raucher, der andere nicht. Die Gesichter wurden verglichen. Raucher und Nichtraucher lassen sich klar unterscheiden.123
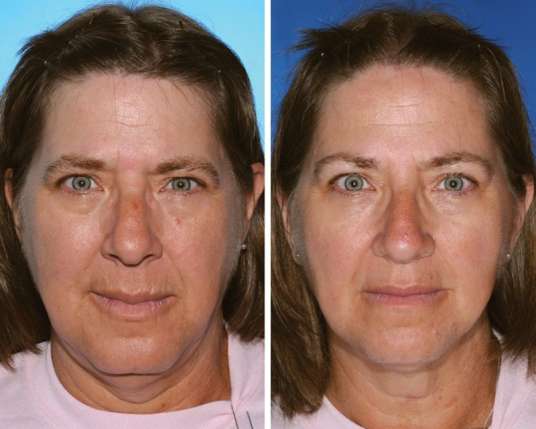 Spuren des Nikotin-Konsums: Beide Zwillingsschwestern waren Raucherinnen, die Frau links allerdings 17 Jahre länger. Entsprechend mehr Falten sind um Nase und Mund zu sehen. © Plastic and Reconstructive Surgery
Spuren des Nikotin-Konsums: Beide Zwillingsschwestern waren Raucherinnen, die Frau links allerdings 17 Jahre länger. Entsprechend mehr Falten sind um Nase und Mund zu sehen. © Plastic and Reconstructive Surgery
Seit dem Rauchverbot sind in der Schweiz die Herzinfarkte zurückgegangen.4
Was ist der Einfluss des Rauchens auf MS?
Die Multiple Sklerose (MS) nimmt bei Rauchern einen schwereren Verlauf und sie schreitet schneller voran als bei Nichtrauchern. DMSG, 15.07.2013
Daten
Es gibt verschiedene Studienresultate und Artikel. Nachfolgend ist eine Liste von Artikel, die mir zum Thema begegnet sind. Dies ist eine unsystematisch erfasste Liste. Es gibt sicher noch andere Studien.
- Manouchehrinia A, Tench CR, Maxted J, Bibani RH, Britton J, Constantinescu CS. Tobacco smoking and disability progression in multiple sclerosis: United Kingdom cohort study. Brain. Juli 2013;136(Pt 7):2298–304.
- Manouchehrinia A, Weston M, Tench CR, Britton J, Constantinescu CS. Tobacco smoking and excess mortality in multiple sclerosis: a cohort study. J Neurol Neurosurg Psychiatry. 25. Feb. 2014;jnnp–2013–307187.
- Hedström AK, Ryner M, Fink K, Fogdell-Hahn A, Alfredsson L, Olsson T, u. a. Smoking and risk of treatment-induced neutralizing antibodies to interferon β-1a. Mult Scler. 1. Apr. 2014;20(4):445–50.
- Briggs FBS, Acuna B, Shen L, Ramsay P, Quach H, Bernstein A, u. a. Smoking and Risk of Multiple Sclerosis: Evidence of Modification by NAT1 Variants, Epidemiology, 12. März 2014
- Multiple Sclerosis Research: Smoking genes increasing your risk of MS., 01.04.2014
- Hedström A, Alfredsson L, Lundkvist Ryner M, Fogdell-Hahn A, Hillert J, Olsson T. Smokers run increased risk of developing anti-natalizumab antibodies. Mult. Scler. 5. Dez. 2013
- Multiple Sclerosis Research: Smoking and Making your Drugs Stop Working., 21.12.2013
- Weiland TJ, Hadgkiss EJ, Jelinek GA, Pereira NG, Marck CH, van der Meer DM. The association of alcohol consumption and smoking with quality of life, disability and disease activity in an international sample of people with multiple sclerosis. J. Neurol. Sci. 15. Jan. 2014;336(1-2):211–9.
- Hedström AK, Hillert J, Olsson T, Alfredsson L. Smoking and multiple sclerosis susceptibility. Eur J Epidemiol. 1–8.
- Asadollahi S, Fakhri M, Heidari K, Zandieh A, Vafaee R, Mansouri B. Cigarette smoking and associated risk of multiple sclerosis in the Iranian population. J Clin Neurosci. 20. Aug. 2013;
- Hedström AK, Hillert J, Olsson T, Alfredsson L. Nicotine might have a protective effect in the etiology of multiple sclerosis. Mult Scler. 1. Juli 2013;19(8):1009–13.
- Salzer J, Hallmans G, Nyström M, Stenlund H, Wadell G, Sundström P. Smoking as a risk factor for multiple sclerosis. Mult Scler. 1. Juli 2013;19(8):1022–7.
Die obigen Studien deuten auf eine Verschlechterung der MS-Krankheit durch Rauchen hin. Bewiesen ist es aber nicht. Doch MS-Betroffene setzen auch auf viele andere „unbewiesene Mittel und Methoden“.
Datenverfügbarkeit
Leider sind viele der obigen Forschungsartikel nicht frei verfügbar (nicht Open Access). Zum Lesen der Artikel können die Autoren um die Forschungsartikel gebeten werden. Um die Wissensverbreitung von Forschungsresultaten zu verbessern, wurde das Open Access Prinzip für den freien Zugang von Forschungsartikeln geschaffen. Insbesondere sollte öffentlich finanzierte Forschung öffentlich zugänglich sein.
Weglassen (Via Negativa)
Medizinische Probleme können durch „hinzufügen von Gutem“ oder durch „weglassen von Schlechtem“ angegangen werden. Im Falle von MS können immunmodulierende Medikamente eingenommen werden, in der Hoffnung, dass sich die Krankheit günstig beeinflussen lässt. Umgekehrt können auch mögliche negative Einflüsse vermindert oder beseitigt werden, beispielsweise die Vermeidung von chronischen Stress.
Das „Weglassen von Schädlichem“ in der Medizin wurde vom Philosophen Nassim Nicolas Taleb als „Via Negativa“ bezeichnet.5 Das „Weglassen von Schädlichem“ ist weniger riskant. Das „Suchen“ von Schädlichem und in der Folge das „Weglassen“ sollte der erste Ansatz bei medizinischen Problemen sein. In einem zweiten Schritt kann danach geprüft werden, ob man „etwas gibt“.
Doch es scheint in der Natuer des Menschen zu liegen, dass er lieber mit „einem Mittel hilf“. Ein Mittel birgt aber immer das Risiko von unerwünschten Nebenwirkungen. Teilweise können Nebenwirkungen von Medikamenten den Einsatz von weiteren Medikamenten zu deren Linderung nachsichziehen.
Anreize
Es ist viel leichter für „ein Mittel“ Geld zu verlangen, als für das Abraten von etwas. Das widerspiegelt sich auch in den Tarifstrukturen des Schweizer Gesundheitssystems.
Da wenig Geld verdient werden kann, gibt es auch wenig „Treiber“ für eine Entwicklung. Forschung und Information werden nicht vorangetrieben.
Nebenwirkungen
Aufhören zu Rauchen ist zu Beginn selbst mit Nebenwirkungen verbunden. Der Stoffwechsel muss sich anpassen und deshalb kommt es häufig zu Gewichtszunahmen. Zu Beginn sollten deshalb Kompensationsmassnahmen wie vermehrte körperliche Betätigung eingeplant werden, beispielsweise können die Fussgänger auf den Lift verzichten oder man kann sich (vermehrt) sportlich betätigten. Wahrscheinlich ist es ratsam die Kompensationsmassnahmen bereits vor dem Aufhören anzufangen.
Patienteninformation
Die Patienteninformation über das Rauchen und MS wird in der Schweiz nicht einheitlich gehandhabt. Jede Klinik und jeder Arzt handhabt es individuell. Das Universitätsspital Genf (HUG) beispielsweise fragt, ob jemand raucht und schlägt das Aufhören vom Rauchen vor.6
Die MS-Gesellschaft bietet aktuell kein Merkblatt zum Thema „Rauchen und MS“ an. Für Sport gibt es bereits die MS-Info Sport und Bewegung. [Aktualisierung 18.05.2014: Im Magazin „FORTE“ der MS-Gesellschaft ist in der neusten Ausgabe 2/2014 (Seite 15) der Artikel „Wie das Rauchen die MS beeinflusst“ erschienen. Der Neurologe Dr. Christian Kamm schreibt: „Schliesslich zeigen rauchende MS-Betroffene eine raschere Behinderungszunahme als nichtrauchende Betroffene. Aufgrund des geschilderten negativen Einflusses des Rauchens auf die MS sowie der anderweitig bekannten Risiken, die durch das Rauchen entstehen, empfiehlt es sich für Menschen mit MS, mit dem Rauchen aufzuhören. Der Rauchstopp nach Ausbruch der Erkrankung wirkt sich erwiesenermassen positiv auf den zukünftigen Verlauf der MS aus.“]
Weglassen von Alkohol, Milch oder Fleisch
Beim Weglassen von anderen Produkten ist die Datenlage weniger klar. Alkohol in vernünftigen Mengen scheint keine negativen Auswirkungen zu haben. Wer jedoch unsicher ist, lässt das Genuss-/Suchtmittel Alkohol besser weg.
Auch das Weglassen von „schädlichen Nahrungsmittel“ könnte helfen. Es gibt jedoch keine gesicherten Information zum Thema was schädlich ist bei MS. Die Ursache von MS ist leider nach wie vor unbekannt und es gibt zu wenig Forschung zum Thema „Ernährung und MS“. Wenn man potentiell schädliche Produkte reduziert, ist das sicher nicht falsch. Wenn man Nahrungsmittel wie Fleisch oder Milch völlig weglässt, sollte man sich informieren. Fleisch beispielsweise hat Proteine und enthält das Vitamin B12. Vitamin B12 kommt in pflanzlicher Nahrung praktisch nicht vor.
Wenn Milch durch Calciumtabletten ersetzt wird, scheint mir dies nicht besonders natürlich zu sein. Abgesehen davon, dass Calcium vom Körper ohne Sonnenlicht viel schlechter aufgenommen wird.
Fazit
Bevor irgendein „Wundermittel“, mit möglicherweise unbekannten Nebenwirkungen, eingenommen wird, sollte geprüft werden, ob es schädliche Faktoren gibt, die vermieden werden können.
Rauchen scheint sich negativ auf den MS-Verlauf auszuwirken. Aufhören zu Rauchen scheint deshalb bei Multiple Sklerose eine sinnvolle Massnahme zu sein. Aber jeder ist selbst verantwortlich für seine Gesundheit und muss deshalb eigenverantwortlich entscheiden.
[Aktualisierung 14.04.2014: Ich habe den Artikel umstrukturiert und leicht überarbeitet.]
[Aktualisierung 18.05.2014: Im Magazin „FORTE“ der MS-Gesellschaft ist in der neusten Ausgabe 2/2014 (Seite 15) der Artikel „Wie das Rauchen die MS beeinflusst“ erschienen. Der Neurologe Dr. Christian Kamm schreibt: „Schliesslich zeigen rauchende MS-Betroffene eine raschere Behinderungszunahme als nichtrauchende Betroffene. Aufgrund des geschilderten negativen Einflusses des Rauchens auf die MS sowie der anderweitig bekannten Risiken, die durch das Rauchen entstehen, empfiehlt es sich für Menschen mit MS, mit dem Rauchen aufzuhören. Der Rauchstopp nach Ausbruch der Erkrankung wirkt sich erwiesenermassen positiv auf den zukünftigen Verlauf der MS aus.“]
[Aktualisierung 09.11.2014: Multiple Sklerose: Tabakqualm und Luftverschmutzungen schaden dem Körper doppelt, dmsg, 4.11.2014]
[Aktualisierung 17.01.2015: Kurzer und klarer Blogartikel von Gavin Giovannoni: Smoking and MS, 17.6.2014]
-
Okada HC, Alleyne B, Varghai K, Kinder K, Guyuron B. Facial Changes Caused by Smoking: A Comparison between Smoking and Nonsmoking Identical Twins. Plastic and Reconstructive Surgery. Nov. 2013;132(5):1085–92.
-
Zwillings-Studie beweist: Raucher sehen älter aus, Blick, 04.11.2013.
-
Twins study shows smoking ages your face faster, CNN, 31.10.2013.
-
Weniger Herzinfarkte dank Rauchverbot. tagesanzeiger.ch: (wid/sda). 9. März 2013
-
Antifragilität: Anleitung für eine Welt, die wir nicht verstehen, Nassim Nicholas Taleb, 2013.
-
Dr. Patrice Lalive, Dr. Caroline Pot, „Risk Factors in MS: Detection and Treatment in Daily Life“, 16. State of the Art Conference of the Swiss Multiple Sclerosis Society, Workshop C, Lucerne, 11.01.2014
Interview mit Alexander Schweitzer – Minister für Soziales, Arbeit, Gesundheit und Demografie des Landes Rheinland-Pfalz
Was schätzen Sie aktuell als die drei größten Herausforderungen des deutschen Gesundheitswesens ein? Und warum?
Letztlich ist der demografische Wandel mit all seinen Facetten und vielschichtigen Folgewirkungen die größte Herausforderung für das deutsche Gesundheitswesen. Dazu gehört zum einen der starke Bevölkerungsrückgang in vielen ländlichen Regionen, der uns zu einer Neuorganisation der Versorgung zwingt. Aber auch die starke Alterung der Bevölkerung – vor allem die deutliche Zunahme der Zahl hochbetagter Menschen – die trotz der insgesamt steigenden Zahl gesunder Lebensjahre doch zu einem Anstieg der Multimorbidität mit sich wandelndem Versorgungsbedarf führt. Schließlich spielen auch die Alterung bei den Beschäftigten im Gesundheitswesen, insbesondere bei den Hausärztinnen und Hausärzten, sowie das sinkende Arbeitskräftepotential eine wichtige Rolle. Diese werden massive Anstrengungen zur Sicherung des Fachkräftenachwuchses im Gesundheitswesen erforderlich machen.
Daraus folgt, dass die Aufrechterhaltung der flächendeckenden medizinischen und pflegerischen Versorgung und damit zusammenhängend die Sicherung des Nachwuchses in den Gesundheitsberufen die größten gesundheitspolitischen Aufgaben über Jahre hinweg sein werden.
Logos in der Gesundheitswirtschaft: Highlights und Verirrungen / Signet eines Gesundheitsinstituts
Ob hier nicht zu viel versprochen wird?
Einsortiert unter:Medical Practice Insights
