Pflanzen bergen einen wahren Schatz an potentiell therapeutisch relevanten Substanzen. Das Problem dabei ist, dass diese von den Pflanzen meist nur in geringen Mengen produziert werden. Jetzt könnte man natürlich probieren, die Pflanzen derart zu manipulieren, dass sie besagte Substanzen in größeren Mengen bilden. Das ist allerdings sehr aufwendig und durch die vergleichsweise lange Generationszeit der meisten Pflanzen auch mühselig. Außerdem wäre das ja dann grüne Gentechnik und wie wir alle wissen ist das ja Teufelszeug. Dann doch lieber rote Gentechnik in Mikroorganismen, die wachsen schneller und die Akzeptanz von mikrobiell hergestellten Substanzen ist offensichtlich auch deutlich höher, wenn man sich die breite Verwendung von Hefeextrakt betrachtet. Marmite lässt grüßen. In der Publikation aus Nature Communications, die ich heute vorstelle, sollte die Produktion des potentiellen Krebsmedikaments Noscapine, das im Schlafmohn gebildet wird, in Hefen verlagert werden. Quasi biologisches Outsourcen. Entdeckt wurde Noscapine 1817 von Pierre-Jean Robiquet und es konnte einige Jahre später gezeigt gezeigt werden, dass Noscapine, im Gegensatz zu anderen Opiaten, weder schmerzlindernd noch Sucht auslösend wirkt. Spätestens seit 1998 ist das Antikrebs-Potential von Noscapine bekannt. Durch seine Bindung an Tubuline, können diese nicht polymerisieren, die für die DNA-Vervielfältigung benötigten Spindelfasern können sich somit nicht ausbilden und die Zelle dann nicht mehr teilen, wodurch sie schließlich stirbt. In den 1960ern konnte gezeigt werden, dass Noscapine aus Scoulerine gebildet wird, allerdings war nichts über die zugrunde liegende Biochemie und die beteiligten Gene bekannt.
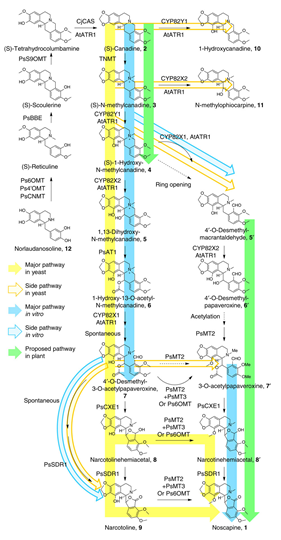
Biosynthese von Noscapine (1) aus Norlaudanosaline (12). Der grüne Pfeil zeigt den im Schlafmohn vermuteten Syntheseweg, blau den Syntheseweg aus in vitro Charakterisierung und gelb den im Artikel Rekonstruierten Syntheseweg in Hefen.
Die Bildung von strukturell komplexen organischen Molekülen, sie dazu die erste Abbildung unten (Organik = Moleküle auf Kohlenstoff-Basis), ist allerdings gar nicht so einfach, wie es zunächst klingt. Will man ein Protein in Hefen oder Bakterien exprimieren lassen, ist das meistens kein Problem. Gen auf Plasmid, rein damit in die Bakterie, fertig. Jetzt sind die meisten Therapeutika aber gar keine Proteine, sondern eben strukturell komplexe organische Moleküle. Wenn man Glück hat, sind schlaue Chemiker in der Lage eine Synthesestrategie ex vivo für das gewünschte Endprodukt zu entwickeln. Wenn man aber nur ein Labor voller Biochemiker zur Verfügung hat, dann muss man sich was anderes überlegen. Am Aufbau der genannten Substanz in Pflanzen sind viel verschiedene Enzyme beteiligt, die jeweils Zwischenprodukte bilden. 2012 konnte ein Gencluster, bestehend aus vier Cytochrom P450 Monooxygenasen, drei Methlytransferasen und jeweils einer Carboxylesterase, Dehydrogenase und Acetyltransferase, als maßgeblich an der Umwandlung von Scoulerine in Noscapine identifiziert werden. So konnte die Biosynthese, die zur Bildung von Noscapine führt, überarbeitet werden, übrigens einer der komplexesten beschriebenen Synthesewege. Die Forscher aus Stanford, des vorgestellten Papers, wollten einen alternativen Syntheseweg erarbeiten, durch den neben Noscapine auch dessen Zwischenprodukte in Hefen hergestellt werden können. Eine Schwierigkeit dabei ist es den natürlichen Syntheseweg, der in Pflanzen in verschiedenen Zelltypen stattfindet in die Hefen zu übertragen.

Testung verschiedener Temperaturen, Promoter und N-Termini zur Optimierung des Enzyms CYP82Y1 des Noscapine-Synthesewegs
Als Ausgangssubstanz wurde Canadine (obere Abbildung, Produkt 2) verwendet, da dessen Biosynthese aus einem Vorläuferprodukt in Hefen kürzlich rekonstruiert werden konnte. Nach und nach wurden die relevanten Gene, die für die Bildung von Noscapine benötigt werden dann in die Hefen eingebracht, entweder über Plasmide, YACs (Artifizielle Hefe-Chromosomen, quasi große Plasmide) oder durch Integration ins Genom der Hefen. Diese Hefen wurden dann mit Canadine gefüttert, d.h. Canadine wird dem Nährmedium zugefügt, und 72 Stunden später wurden die gebildeten Metaboliten analysiert. Dabei wurden die einzelnen Enzyme, die für die verschiedenen Zwischenprodukte benötigt wurden jeweils einzeln optimiert. Zunächst stand dabei das Zwischenprodukt 4 (obere Abbildung, (S)-1-Hydroxy-N-methylcanadine) im Fokus, für das drei verschiedenen Enzyme benötigt wurden. Die Syntheserate war allerdings mit 20% ziemlich gering, was insofern problematisch ist, da ja noch viele weitere Schritte folgen, die jeweils auch wieder keine 100%ige Umsatzrate haben werden. Um das Schlüsselenzym dieses Schritts zu optimieren wurden unterschiedliche Temperaturen in Kombination mit verschiedenen Promotern (das sind DNA-Sequenzen, die jeweils vor der Sequenz eines Gens liegen und Bindungsstellen liefern für andere Proteine liefern, die dann dafür sorgen, dass das Gen abgelesen werden kann) und verschiedenen N-Termini (dabei werden innerhalb des zu optimierenden Enzyms die Endstücke, der N-Terminus, mit denen anderer bekannter Enzyme mit ähnlicher Funktion ausgetauscht). Wie stark das die Umsetzungsrate beeinflussen kann, seht ihr in der nächsten Abbildung. Und eben das wurde auch für die weiteren Schritte des Synthesewegs getan. Schließlich konnte so die Biosynthese von Noscapine aus Canadine mehr als siebenfach erhöht werden, so dass am Ende eine Umsetzungsrate von ~6% erreicht wird. Alternativ sind so auch die Zwischenprodukte zugänglich, indem man einfach nur einen Teil der beteiligten Enzyme in die Hefen einbringt. Besonders schwierig ist bei dem beschriebene Syntheseweg die Anwesenheit von insgesamt mehreren Cytochrom P450s in den Hefen, da hier beobachtet wurde, dass die Umsetzungsrate von jedem P450 auf das nächste sukzessive abnimmt. In weiteren Arbeiten wird sich also auch darauf konzentriert werden müssen, die Hefen selbst derart zu optimieren, dass mehrere P450s ein geringeres Problem darstellt.
Die verwendete Ausgangssubstanz Canadine wird allerdings selbst durch Hefen gebildet, was diese sehr teuer macht. Besser wäre es, wenn es möglich wäre Noscapine aus einem einfach zugänglichen und günstigen Vorläuferprodukt zu synthetisieren. im Idealfall wäre das Tyrosin, die Aminosäure aus der Noscapine in Pflanzen natürlicherweise gebildet wird. Dazu könnten z.B. die beiden synthetisierten Hefestämme (also der Canadine- und der Noscapine-produzierende Hefestamm) zusammen geführt werden. Man könnte allerdings auch die beiden Stämme gemeinsam kultivieren. Da die gebildeten Zwischenprodukte ins Nährmedium außerhalb der Hefen abgegeben werden, könnten diese sich gegenseitig mit Substraten versorgen. Es ist auf jeden Fall noch einiges zu tun, aber so ist das ja immer. Ein Problem gelöst, viele neue Fragen aufgeworfen.
